Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое марганец - определение
ХИМИЧЕСКИЙ ЭЛЕМЕНТ С ПОРЯДКОВЫМ НОМЕРОМ 25
Mn; Manganum; Марганец, химический элемент
Марганец
2) Джезды
марганец
Марганец
I
Ма́рганец (лат. Manganum)
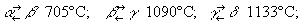
Mn, химический элемент VII группы периодической системы Менделеева; атомный номер 25, атомная масса 54,9380; тяжёлый серебристо-белый металл. В природе элемент представлен одним стабильным изотопом 55Mn.
Историческая справка. Минералы М. известны издавна. Древнеримский натуралист Плиний упоминает о чёрном камне, который использовали для обесцвечивания жидкой стеклянной массы; речь шла о минерале пиролюзите MnO2. В Грузии пиролюзит с древнейших времён служил присадочным материалом при получении железа. Долгое время пиролюзит называли чёрной магнезией и считали разновидностью магнитного железняка (Магнетита). В 1774 К. Шееле показал, что это соединение неизвестного металла, а другой шведский учёный Ю. Ган, сильно нагревая смесь пиролюзита с углём, получил М., загрязнённый углеродом. Название М. традиционно производят от немецкого Manganerz - марганцевая руда.
Распространение в природе. Среднее содержание М. в земной коре 0,1 \%, в большинстве изверженных пород 0,06-0,2 \% по массе, где он находится в рассеянном состоянии в форме Mn2+ (аналог Fe2+). На земной поверхности Mn2+ легко окисляется, здесь известны также минералы Mn3+ и Mn4+ (см. Марганцевые руды). В биосфере М. энергично мигрирует в восстановительных условиях и малоподвижен в окислительной среде. Наиболее подвижен М. в кислых водах тундры и лесных ландшафтов, где он находится в форме Mn2+. Содержание М. здесь часто повышено и культурные растения местами страдают от избытка М.; в почвах, озёрах, болотах образуются железо-марганцевые конкреции, озёрные и болотные руды. В сухих степях и пустынях в условиях щелочной окислительной среды М. малоподвижен, организмы бедны М., культурные растения часто нуждаются в марганцевых микроудобрениях. Речные воды бедны М. (10-6-10-5 г/л), однако суммарный вынос этого элемента реками огромен, причём основная его масса осаждается в прибрежной зоне. Ещё меньше М. в воде озёр, морей и океанов; во многих местах океанического дна распространены железо-марганцевые конкреции, образовавшиеся в прошлые геологические периоды.
Физические и химические свойства. Плотность М. 7,2-7,4 г/см3, tпл 1245 °С; tкип 2150 °C. М. имеет 4 полиморфные модификации: α-Mn (кубическая объёмноцентрированная решётка с 58 атомами в элементарной ячейке), β-Mn (кубическая объёмноцентрированная с 20 атомами в ячейке), γ-Mn (тетрагональная с 4 атомами в ячейке) и δ-Mn (кубическая объёмноцентрированная). Температура превращений:
α-модификация хрупка; γ (и отчасти β) пластична, что имеет важное значение при создании сплавов.
Атомный радиус М. 1,30 Å. Ионные радиусы (в Å): Mn2+ 0,91, Mn4+ 0,52, Mn7+ 0,46. Прочие физические свойства α-Mn: удельная теплоёмкость(при 25 °С) 0,478 кдж/(кг·К) [то есть 0,114 кал/ (г·°С)]; температурный коэффициент линейного расширения (при 20 °С) 22,3․10-6 град -1 теплопроводность (при 25 °С) 66,57 вт/(м․К) [то есть 0,159 кал/(см·сек °С)]; удельное объёмное электрическое сопротивление 1,5-2,6 мком·м (то есть 150-260 мком·см); температурный коэффициент электрического сопротивления (2-3)․10-4 град -1 М. парамагнитен.
Химически М. достаточно активен, при нагревании энергично взаимодействует с неметаллами - кислородом (образуется смесь окислов М. разной валентности), азотом (Mn4N, Mn2N1, Mn3N2), серой (MnS, MnS2), углеродом (Mn3C, Mn23C6, Mn7C3, Mn5C6), фосфором (Mn2P, MnP) и др. При комнатной температуре М. на воздухе не изменяется; очень медленно реагирует с водой. В кислотах (соляной, разбавленной серной) легко растворяется, образуя соли двухвалентного М. При нагревании в вакууме М. легко испаряется даже из сплавов.
М. образует сплавы со многими химическими элементами; большинство металлов растворяется в отдельных его модификациях и стабилизирует их. Так, Cu, Fe, Со, Ni и другие стабилизируют γ-модификацию. Al, Ag и другие расширяют области β- и σ-Mn в двойных сплавах. Это имеет важное значение для получения сплавов на основе М., поддающихся пластической деформации (ковке, прокатке, штамповке).
В соединениях М. обычно проявляет валентность от 2 до 7 (наиболее устойчивы степени окисления +2, +4 и +7). С увеличением степени окисления возрастают окислительные и кислотные свойства соединений М.
Соединения Mn(+2) - восстановители. Окись MnO - порошок серо-зелёного цвета; обладает основными свойствами, нерастворима в воде и щелочах, хорошо растворима в кислотах. Гидроокись Mn(OH)2 - белое вещество, нерастворимое в воде. Соединения Mn(+4) могут выступать и как окислители (а) и как восстановители (б):
MnO2+4HCl = MnCl2 + Cl2 + 2H2O (a)
(по этой реакции в лабораториях получают Хлор)
MnO2 + KClO3 + 6KOH = ЗК2МnO4 + KCl + ЗН2О (б)
(реакция идёт при сплавлении).
Двуокись MnO2 - черно-бурого цвета, соответствующая гидроокись Mn(OH)4 - темно-бурого цвета. Оба соединения в воде нерастворимы, оба амфотерны с небольшим преобладанием кислотной функции. Соли типа K4MnO4 называются манганитами.
Из соединений Mn(+6) наиболее характерны Марганцовистая кислота и её соли манганаты. Весьма важны соединения Mn(+7) - марганцовая кислота, марганцовый ангидрид и Перманганаты.
Получение. Наиболее чистый М. получают в промышленности по способу советского электрохимика Р. И. Агладзе (1939) электролизом водных растворов MnSO4 с добавкой (NH4)2SO4 при pH = 8,0-8,5. Процесс ведут с анодами из свинца и катодами из титанового сплава АТ-3 или нержавеющей стали. Чешуйки М. снимают с катодов и, если необходимо, переплавляют. Галогенным процессом, например хлорированием руды Mn, и восстановлением галогенидов получают М. с суммой примесей около 0,1 \%. Менее чистый М. получают алюминотермией (См. Алюминотермия) по реакции:
3Мn3O4 + 8Al = 9Mn + 4Al2O3,
а также электротермией (См. Электротермия).
Применение. Основной потребитель М. - чёрная металлургия, расходующая в среднем около 8-9 кг М. на 1 т выплавляемой стали. Для введения М. в сталь применяют чаще всего его сплавы с железом - ферромарганец (70-80 \% М., 0,5-7,0 \% углерода, остальное железо и примеси). Выплавляют его в доменных и электрических печах (см. Ферросплавы). Высокоуглеродистый ферромарганец служит для раскисления и десульфурации стали; средне- и малоуглеродистый - для легирования стали. Малолегированная конструкционная и рельсовая сталь содержит 0,9-1,6 \% Mn; высоколегированная, очень износоустойчивая сталь с 15 \% Mn и 1,25 \% C (изобретена английским металлургом Р. Гейрилдом в 1883) была одной из первых легированных сталей. В СССР производится безникелевая нержавеющая сталь, содержащая 14 \% Cr и 15 \% Mn.
М. используется также в сплавах на нежелезной основе (см., например, Манганин). Сплавы меди с М. применяют для изготовления турбинных лопаток; марганцовые бронзы - при производстве пропеллеров и других деталей, где необходимо сочетание прочности и коррозионной устойчивости. Почти все промышленные Алюминиевые сплавы и Магниевые сплавы содержат М. Разработаны деформируемые сплавы на основе М., легированные медью, никелем и другими элементами. Гальваническое покрытие М. применяется для защиты металлических изделий от коррозии.
Соединения М. применяют и при изготовлении гальванических элементов; в производстве стекла и в керамической промышленности; в красильной и полиграфической промышленности, в сельском хозяйстве (см. Микроудобрения) и т. д.
Ф. Н. Тавадзе.
Марганец в организме. М. широко распространён в природе, являясь постоянной составной частью растительных и животных организмов. Содержание М. в растениях составляет десятитысячные - сотые, а в животных - стотысячные - тысячные доли процента. Беспозвоночные животные богаче М., чем позвоночные. Среди растений значительное количество М. накапливают некоторые ржавчинные грибы, водяной орех, ряска, бактерии родов Leptothrix, Crenothrix и некоторые диатомовые водоросли (Cocconeis) (до нескольких процентов в золе), среди животных - рыжие муравьи, некоторые моллюски и ракообразные (до сотых долей процента). М. - активатор ряда ферментов, участвует в процессах дыхания, фотосинтезе, биосинтезе нуклеиновых кислот и др., усиливает действие инсулина и других гормонов, влияет на кроветворение и Минеральный обмен. Недостаток М. у растений вызывает Некрозы, хлороз яблони и цитрусовых, пятнистость злаков, ожоги у картофеля, ячменя и т. п. М. обнаружен во всех органах и тканях человека (наиболее богаты им печень, скелет и щитовидная железа). Суточная потребность животных и человека в М. - несколько мг (ежедневно с пищей человек получает 3-8 мг М.). Потребность в М. повышается при физической нагрузке, при недостатке солнечного света; дети нуждаются в большем количестве М., чем взрослые. Показано, что недостаток М. в пище животных отрицательно влияет на их рост и развитие, вызывает анемию, так называемую лактационную тетанию, нарушение минерального обмена костной ткани. Для предотвращения указанных заболеваний в корм вводят соли М.
Г. Я. Жизневская.
В медицине некоторые соли М. (например, KMnO4) применяют как дезинфицирующие средства (см. Перманганат калия). Соединения М., применяемые во многих отраслях промышленности, могут оказывать токсическое действие на организм. Поступая в организм главным образом через дыхательные пути, М. накапливается в паренхиматозных органах (печень, селезёнка), костях и мышцах и выводится медленно, в течение многих лет. Предельно допустимая концентрация соединений М. в воздухе - 0,3 мг/м3. При выраженных отравлениях наблюдается поражение нервной системы с характерным синдромом марганцевого Паркинсонизма.
Лечение: витаминотерапия, холинолитические средства и др. Профилактика: соблюдение правил гигиены труда.
Лит.: Салли А. Х., Марганец, перевод с английского, М., 1959; Производство ферросплавов, 2 изд., М., 1957; Пирсон А., Марганец и его роль в фотосинтезе, в сборнике: Микроэлементы, перевод с английского, М., 1962.
II
Ма́рганец
город в Днепропетровской области УССР. Расположен на берегу Каховского водохранилища. Железнодорожная станция на линии Кривой Рог - Запорожье. 48,9 тысячи жителей (1973).
Основан в 1883-86 как рабочий посёлок в связи с началом разработки марганцевого месторождения; преобразован в город в 1938. К 1940 в городе было 20 шахт и 4 обогатительных фабрики. В годы Великой Отечественной войны 1941-45 М. с 17 августа 1941 до 5 февраля 1944 был оккупирован немецко-фашистскими войсками, нанёсшими городу большой урон. В первую послевоенную пятилетку город и его промышленные предприятия были полностью восстановлены; в последующие десятилетия получили развитие экономика, наука и культура. Современный М. - крупный центр Никопольского марганцеворудного бассейна. Имеется горно-обогатительный комбинат по добыче и переработке марганцевой руды, который является поставщиком марганцевого концентрата для металлургических предприятий страны и экспорта. Заводы: рудоремонтный, строительных материалов; фабрики: кондитерская, швейная, мебельная, лентоткацкая. Предприятия пищевой промышленности. Лесомелиоративная станция. Вечернее отделение Криворожского горнорудного института, горный техникум. Историко-краеведческий музей.
Википедия
Марганец

Ма́рганец (химический символ — Mn, от лат. Manganum) — химический элемент 7-й группы (по устаревшей классификации — побочной подгруппы седьмой группы, VIIB), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 25.
Простое вещество марганец — это твёрдый, но одновременно с этим, хрупкий переходный металл серебристо-белого цвета. Относится к цветным металлам.
Примеры употребления для марганец
1. Марганец используется для производства спецсталей.
2. Например, весь марганец, на котором работают, - привозной.
3. Основные активные вещества - кальций, магний, железо, марганец.
4. Я предлагаю: нужно создать программу "Марганец". Молчание...
5. Молоко выводит из организма свинец, марганец, никель.


![[[Диаграмма Пурбе]] для марганца [[Диаграмма Пурбе]] для марганца](https://commons.wikimedia.org/wiki/Special:FilePath/Poutbaix-mn.png?width=200)
